반응형
1999학년도 대학수학능력시험 과학(자연계선택/화학Ⅱ)
시행 : 1998.11.18(수)
대상 : 고등학교 3학년
출제 : 교육과정평가원
1998-11 고3 수능 6과학(자연계선택)(화학Ⅱ)[문제].pdf
0.35MB
1998-11 고3 수능 6과학(자연계선택)(화학Ⅱ)[정답].pdf
0.02MB



삽화, 사진, 표는 누락되어 있습니다. 원본 파일을 참고하시기 바랍니다.
65. 철수는 원자 반지름과 이온 반지름의 관계를 알아보기 위하 여 다음과 같은 그림을 그려 보았다.
위 그림에 관한 <보기>의 설명 중 옳은 것을 모두 고르면?
<보 기>
ㄱ. 그림에 주어진 이온들은 전자수는 같으나 핵의 전하가 다르다.
ㄴ. 보다 원자 반지름이 큰 이유는 전자 껍질수가 증가하기 때문이다.
ㄷ. , , 의 이온 반지름은 그에 해당하는 원자 반지름 보다 작다.
ㄴ. 보다 원자 반지름이 큰 이유는 전자 껍질수가 증가하기 때문이다.
ㄷ. , , 의 이온 반지름은 그에 해당하는 원자 반지름 보다 작다.
① ㄱ
② ㄴ
③ ㄱ, ㄴ
④ ㄱ, ㄷ
⑤ ㄴ, ㄷ
66. 다음은 할로겐화수소()의 물리적 성질을 나타낸 것이다.
| 할로겐화수소() | ||||
| 끓는점 (℃) | 20 | -85 | -67 | -35 |
| 수소 결합 | 있음 | 없음 | 없음 | 없음 |
| 전기 음성도 차 | 1.9 | 0.9 | 0.7 | 0.4 |
| 분자량 | 20.0 | 36.5 | 80.9 | 127.9 |
위 자료에 대한 해석으로 옳은 것을 <보기>에서 모두 고르면?
<보 기>
ㄱ. 의 끓는점이 높은 것은 수소 결합 때문이다.
ㄴ. 전기 음성도 차이가 제일 큰 는 가장 강한 산일 것이다.
ㄷ. 끓는점이 의 순으로 높아지는 것은 분산력이 증가되기 때문이다.
ㄴ. 전기 음성도 차이가 제일 큰 는 가장 강한 산일 것이다.
ㄷ. 끓는점이 의 순으로 높아지는 것은 분산력이 증가되기 때문이다.
① ㄱ
② ㄴ
③ ㄷ
④ ㄱ, ㄷ
⑤ ㄴ, ㄷ
67. 그림은 흑연과 다이아몬드가 산소와 반응하여 이산화탄소가 될 때의 엔탈피 변화를 나타낸 것이다.
위 그림을 통하여 알 수 있는 것을 <보기>에서 모두 고르면?
<보 기>
ㄱ. 반응 A, B는 모두 발열 반응이다.
ㄴ. 흑연이 다이아몬드로 변하는 반응은 발열 반응이다.
ㄷ. 반응 A, B의 반응열은 각각 다이아몬드와 흑연의 연소열에 해당한다.
ㄴ. 흑연이 다이아몬드로 변하는 반응은 발열 반응이다.
ㄷ. 반응 A, B의 반응열은 각각 다이아몬드와 흑연의 연소열에 해당한다.
① ㄱ
② ㄴ
③ ㄷ
④ ㄱ, ㄴ
⑤ ㄱ, ㄷ
68. 다음은 물의 상평형 그림이다.
<보기>는 상평형 그림을 이용하여 설명할 수 있는 자연 현상을 나타낸 것이다.
<보 기>
(가) 높은 산 위에서는 밥이 설익는다.
(나) 추운 겨울에 밖에 널어 놓은 언 빨래가 마른다.
(다) 얼음 위에 스케이트를 신고 올라서면 얼음이 녹는다.
(나) 추운 겨울에 밖에 널어 놓은 언 빨래가 마른다.
(다) 얼음 위에 스케이트를 신고 올라서면 얼음이 녹는다.
각 상평형 곡선과 <보기>의 자연 현상을 바르게 관련지은 것은?
① (가) : AT / (나) : BT / (다) : CT
② (가) : AT / (나) : CT / (다) : BT
③ (가) : BT / (나) : AT / (다) : CT
④ (가) : BT / (나) : CT / (다) : AT
⑤ (가) : CT / (나) : AT / (다) : BT
69. 수소()와 요오드()가 반응하여 요오드화수소()가 생성될 때의 반응 속도식은 다음과 같다.
일정한 온도에서 일정 부피의 반응 용기로 아래 표와 같이 와 의 농도를 변화시키면서 반응 속도를 측정하였다.
| 농도 \ 실험 | 1 | 2 | 3 | 4 | 5 |
| [](mol/L) | 0.01 | 0.03 | 0.05 | 0.07 | 0.09 |
| [](mol/L) | 0.09 | 0.07 | 0.05 | 0.03 | 0.01 |
영희가 얻을 수 있는 실험 결과를 바르게 나타낸 것은?
70. 원자의 구조는 화학 현상을 이해하는데 매우 중요하다. 오른쪽 그림은 바닥 상태의 수소 원자 1s 오비탈의 전자 구름 모형을 나타낸 것이다. 수소 원자에 관한 <보기>의 설명 중 옳은 것을 모두 고르면? [2점]
<보 기>
ㄱ. 원자핵의 크기는 원자의 크기와 같다.
ㄴ. 전자 구름의 끝을 명확하게 정할 수 없다.
ㄷ. 핵으로부터 거리가 같으면 전자가 발견될 확률은 같다.
ㄹ. 전자 구름 모형에서 각각의 점들은 전자 하나에 해당한다.
ㄴ. 전자 구름의 끝을 명확하게 정할 수 없다.
ㄷ. 핵으로부터 거리가 같으면 전자가 발견될 확률은 같다.
ㄹ. 전자 구름 모형에서 각각의 점들은 전자 하나에 해당한다.
① ㄱ, ㄴ
② ㄱ, ㄷ
③ ㄴ, ㄷ
④ ㄴ, ㄹ
⑤ ㄷ, ㄹ
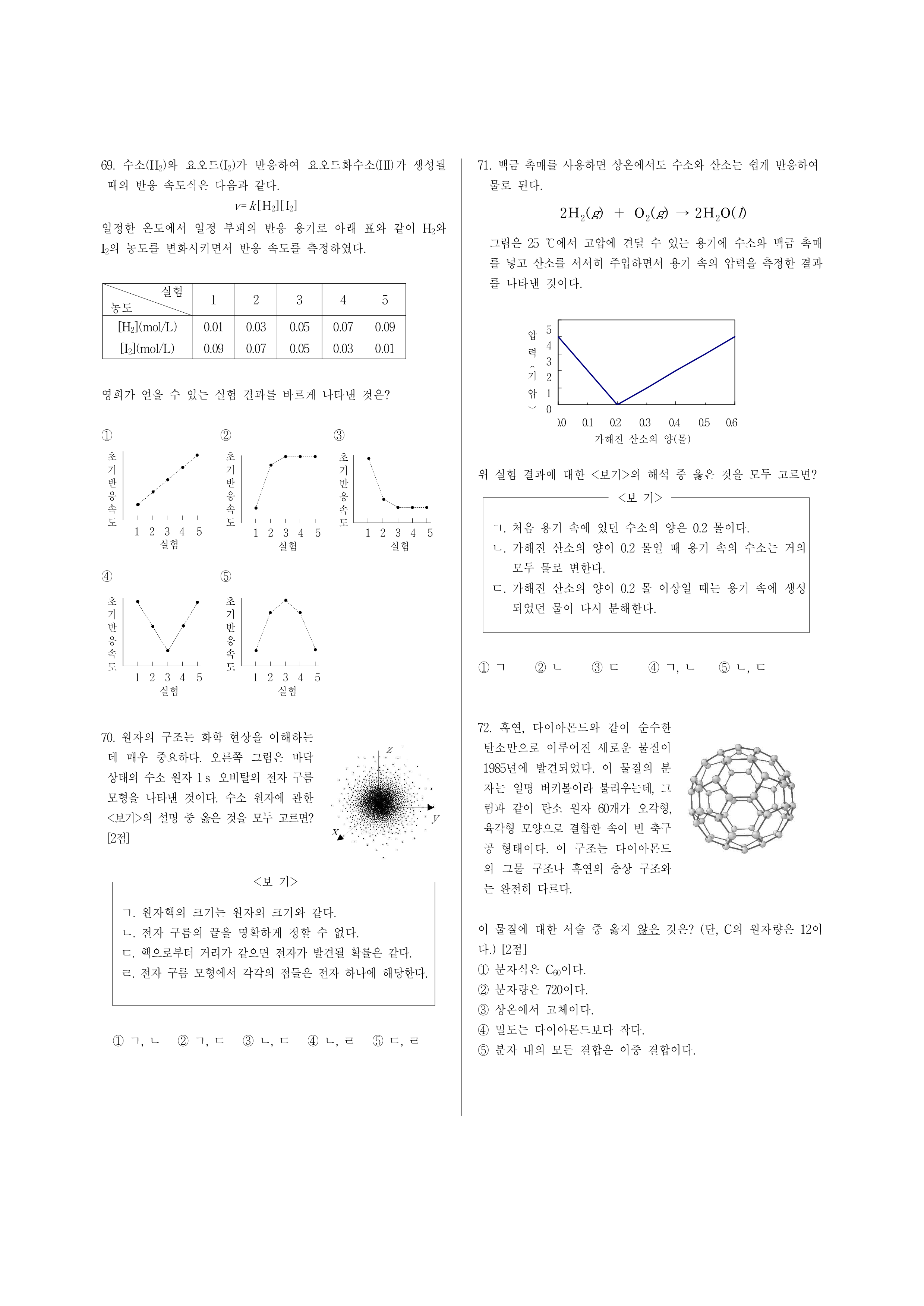
71. 백금 촉매를 사용하면 상온에서도 수소와 산소는 쉽게 반응하여 물로 된다.
그림은 25 ℃에서 고압에 견딜 수 있는 용기에 수소와 백금 촉매를 넣고 산소를 서서히 주입하면서 용기 속의 압력을 측정한 결과를 나타낸 것이다.
위 실험 결과에 대한 <보기>의 해석 중 옳은 것을 모두 고르면?
<보 기>
ㄱ. 처음 용기 속에 있던 수소의 양은 0.2 몰이다.
ㄴ. 가해진 산소의 양이 0.2 몰일 때 용기 속의 수소는 거의 모두 물로 변한다.
ㄷ. 가해진 산소의 양이 0.2 몰 이상일 때는 용기 속에 생성되었던 물이 다시 분해한다.
ㄴ. 가해진 산소의 양이 0.2 몰일 때 용기 속의 수소는 거의 모두 물로 변한다.
ㄷ. 가해진 산소의 양이 0.2 몰 이상일 때는 용기 속에 생성되었던 물이 다시 분해한다.
① ㄱ
② ㄴ
③ ㄷ
④ ㄱ, ㄴ
⑤ ㄴ, ㄷ
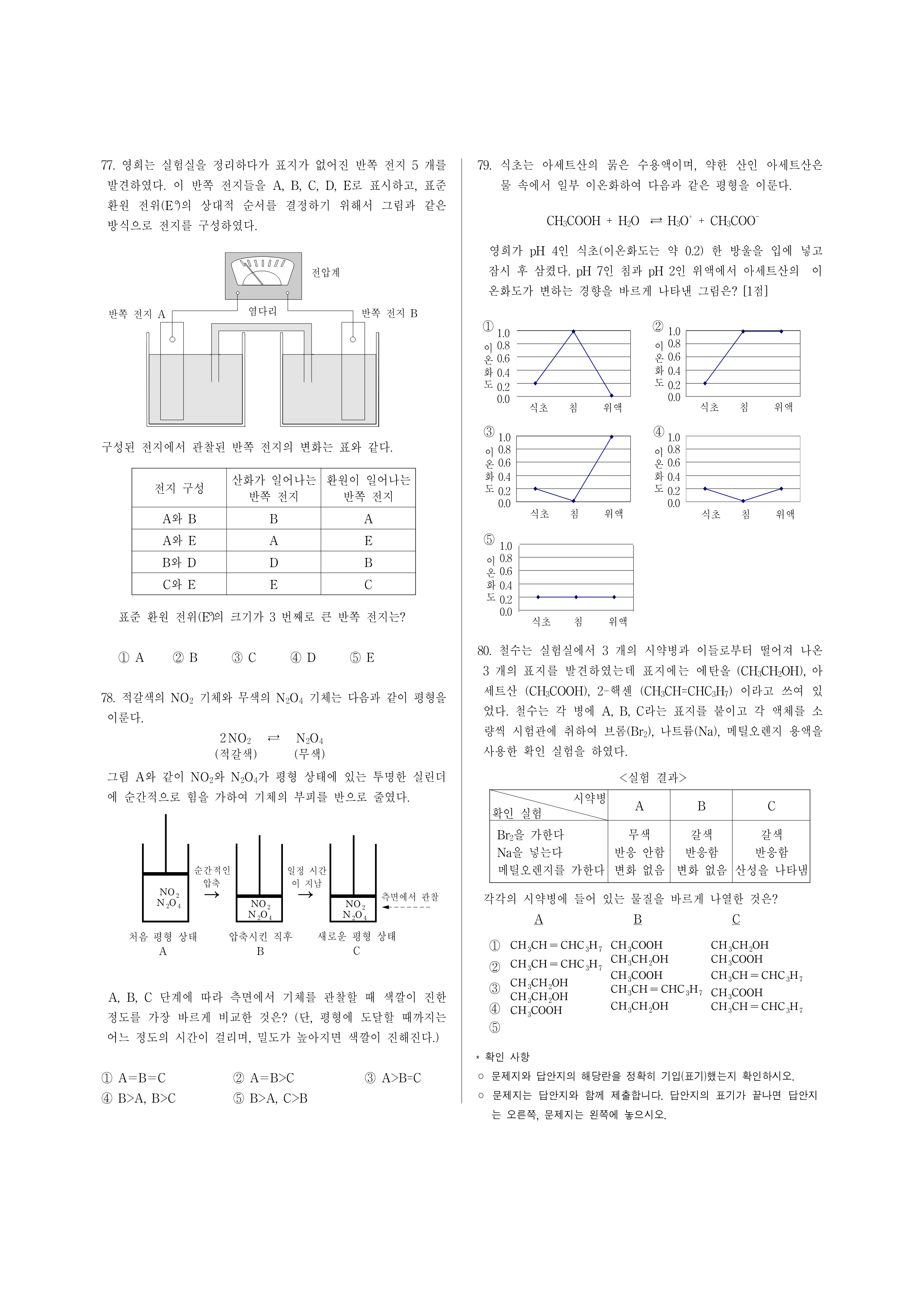
72. 흑연, 다이아몬드와 같이 순수한 탄소만으로 이루어진 새로운 물질이 1985년에 발견되었다. 이 물질의 분자는 일명 버키볼이라 불리우는데, 그림과 같이 탄소 원자 60개가 오각형, 육각형 모양으로 결합한 속이 빈 축구공 형태이다. 이 구조는 다이아몬드의 그물 구조나 흑연의 층상 구조와는 완전히 다르다.
이 물질에 대한 서술 중 옳지 않은 것은? (단, 의 원자량은 12이다.) [2점]
① 분자식은 이다.
② 분자량은 720이다.
③ 상온에서 고체이다.
④ 밀도는 다이아몬드보다 작다.
⑤ 분자 내의 모든 결합은 이중 결합이다.
73. 철수는 그림과 같이 큰 유리 용기 속에 물과 황산구리 용액이 각각 든 비커를 넣고 유리판을 덮었다.
표는 유리 용기를 유리판으로 덮은 후 시간에 따른 두 비커 속의 액체 높이를 나타낸 것이다. (단, 비커의 크기는 같다.)
| 경과 시간(시간) | 0 | 2 | 4 | 6 | 8 |
| 물의 높이(mm) | 100 | 98 | 97 | 96 | 95 |
| 황산구리용액의 높이(mm) | 100 | 101 | 102 | 103 | 104 |
위 실험 결과에 대한 <보기>의 설명 중 옳은 것을 모두 고르면?
<보 기>
ㄱ. 황산구리 용액의 농도는 점점 묽어진다.
ㄴ. 두 액체 표면에서 증발하는 물의 양은 같다.
ㄷ. 용기 위의 유리판을 제거해도 액체 높이의 변화는 위 실험 결과와 같을 것이다.
ㄴ. 두 액체 표면에서 증발하는 물의 양은 같다.
ㄷ. 용기 위의 유리판을 제거해도 액체 높이의 변화는 위 실험 결과와 같을 것이다.
74. 오른쪽 그림은 에텐(에틸렌) 분자 내 탄소의 핵간 거리에 따른 에너지 곡선이다. 에너지가 가장 낮을 때 핵간 거리가 결합 길이이며, 이 때 결합을 끊는 데 필요한 에너지가 결합 에너지이다.
에틴(아세틸렌) 분자의 경우, 이와 같은 에너지 곡선을 그렸을 때 A점의 이동 방향을 바르게 예측한 것은? [1점]
① 핵간 거리(축) : 오른쪽 / 에너지(축) : 아래쪽
② 핵간 거리(축) : 오른쪽 / 에너지(축) : 위쪽
③ 핵간 거리(축) : 왼쪽 / 에너지(축) : 아래쪽
④ 핵간 거리(축) : 왼쪽 / 에너지(축) : 위쪽
⑤ 핵간 거리(축) : 변화 없음 / 에너지(축) : 위쪽
75. 영희는 분자식이 같은 형태인 와 는 극성이 서로 다르다는 사실을 알게 되었다. 이러한 극성의 차이를 알아보기 위하여 영희는 몇 가지 화합물의 자료를 다음과 같이 분류하였다. (단, 중심 원자의 원자가 전자쌍 수 = 중심 원자의 공유 전자쌍 수 + 중심 원자의 비공유 전자쌍 수)
| 분자 | 극성 | 중심 원자의 원자가 전자쌍 수 | 중심 원자의 공유 전자쌍 수 |
| 무극성 | 2 | 2 | |
| 무극성 | 3 | 3 | |
| 무극성 | 4 | 4 | |
| 무극성 | 5 | 5 | |
| 극성 | 4 | 2 | |
| 극성 | 4 | 3 |
이 자료를 근거로 이들 화합물의 극성을 예측하는데 가장 적절한 정보를 고르면?
① 중심 원자의 종류
② 중심 원자의 공유 전자쌍 수
③ 중심 원자의 원자가 전자쌍 수
④ 중심 원자에 결합된 원자의 종류
⑤ 중심 원자의 비공유 전자쌍 존재 유무
76. 영희는 물질이 열을 받으면 분자의 운동이 활발해진다는사실을알았다. 오른쪽 그림은 1기압에서 고체 상태인 분자성 물질 일정량을 가열했을 때 시간에 따른 온도 변화를 나타낸 것이다. (단, 같은 시간에 가해지는 열량은 같다.)
<보기>에서 이 물질의 온도에 따른 성질의 변화를 바르게 표현한 것을 모두 고르면?
① ㄱ, ㄴ
② ㄱ, ㄷ
③ ㄴ, ㄷ
④ ㄴ, ㄹ
⑤ ㄷ, ㄹ
77. 영희는 실험실을 정리하다가 표지가 없어진 반쪽 전지 5 개를 발견하였다. 이 반쪽 전지들을 A, B, C, D, E로 표시하고, 표준 환원 전위(E˚)의 상대적 순서를 결정하기 위해서 그림과 같은 방식으로 전지를 구성하였다.
구성된 전지에서 관찰된 반쪽 전지의 변화는 표와 같다.
| 전지 구성 | 산화가 일어나는 반쪽 전지 | 환원이 일어나는 반쪽 전지 |
| A와 B | B | A |
| A와 E | A | E |
| B와 D | D | B |
| C와 E | E | C |
표준 환원 전위(E˚)의 크기가 3 번째로 큰 반쪽 전지는?
① A
② B
③ C
④ D
⑤ E
78. 적갈색의 기체와 무색의 기체는 다음과 같이 평형을 이룬다.
그림 A와 같이 와 가 평형 상태에 있는 투명한 실린더에 순간적으로 힘을 가하여 기체의 부피를 반으로 줄였다.
A, B, C 단계에 따라 측면에서 기체를 관찰할 때 색깔이 진한 정도를 가장 바르게 비교한 것은? (단, 평형에 도달할 때까지는 어느 정도의 시간이 걸리며, 밀도가 높아지면 색깔이 진해진다.)
①
②
③
④ ,
⑤ ,
79. 식초는 아세트산의 묽은 수용액이며, 약한 산인 아세트산은 물 속에서 일부 이온화하여 다음과 같은 평형을 이룬다.
영희가 pH 4인 식초(이온화도는 약 0.2) 한 방울을 입에 넣고 잠시 후 삼켰다. pH 7인 침과 pH 2인 위액에서 아세트산의 이온화도가 변하는 경향을 바르게 나타낸 그림은? [1점]
80. 철수는 실험실에서 3개의 시약병과 이들로부터 떨어져 나온 3개의 표지를 발견하였는데 표지에는 에탄올 (), 아세트산 (), 2-핵센 ()이라고 쓰여 있었다. 철수는 각 병에 A, B, C라는 표지를 붙이고 각 액체를 소량씩 시험관에 취하여 브롬(), 나트륨(), 메틸오렌지 용액을 사용한 확인 실험을 하였다.
<실험 결과>
| 확인 실험 \ 시약병 | A | B | C |
| 을 가한다 을 넣는다 메틸오렌지를 가한다 | 무색 반응 안함 변화 없음 | 갈색 반응함 변화 없음 | 갈색 반응함 산성을 나타냄 |
① A : / B : / C :
② A : / B : / C :
③ A : / B : / C :
④ A : / B : / C :
⑤ A : / B : / C :
'고3 > 과학' 카테고리의 다른 글
| 1998-11 고3 수능 과학(자연계선택/지구과학Ⅱ) (0) | 2023.02.07 |
|---|---|
| 1998-11 고3 수능 과학(자연계선택/생물Ⅱ) (0) | 2023.02.07 |
| 1998-11 고3 수능 과학(자연계선택/물리Ⅱ) (0) | 2023.02.07 |
| 1998-11 고3 수능 과학(자연계공통) (0) | 2023.02.07 |
| 1998-11 고3 수능 과학(인문계) (0) | 2023.02.07 |