반응형
2002학년도 3월 고3 전국연합학력평가 과학(자연계선택/화학Ⅱ)
시행 : 2002.03.28(목)
대상 : 고등학교 3학년
출제 : 서울교육청
2002-03 고3 학평 6과학(자연계선택)(화학Ⅱ)[문제].pdf
0.30MB
2002-03 고3 학평 6과학(자연계선택)(화학Ⅱ)[해설].pdf
0.17MB



삽화, 사진, 표는 누락되어 있습니다. 원본 파일을 참고하시기 바랍니다.
65. 표는 세가지 물질 , , 각각 1g 속에 들어 있는 원자수를 조사한 자료이다. (단, , , 는 임의의 원소 기호이다.)
| 물질 | |||
| 1g 중의 원자수() | 5.0 | 3.75 | 2.5 |
위 자료로부터 원소 , , 의 원자량을 바르게 비교한 것은?
①
②
③
④
⑤
66. 2원자 분자인 기체 A와 기체 B를 반응시키면 기체 C가 생성된다. 표는 일정한 온도와 압력에서 기체 A와 기체 B의 양을 달리하여 반응시켰을 때, 반응하지 않고 남은 기체의 부피를 나타낸 것이다.
| 실험 | (가) | (나) | (다) | (라) | (마) |
| 기체 A의 부피(mL) | 80 | 70 | 60 | 50 | 40 |
| 기체 B의 부피(mL) | 10 | 20 | 30 | 40 | 50 |
| 반응하지 않고 남은 기체의 부피(mL) | 60 | 30 | 0 | 15 | 30 |
위 자료를 해석한 <보기>의 설명 중 옳은 것을 모두 고르면? [2점]
<보 기>
ㄱ. 기체 C는 2원자 분자이다.
ㄴ. 실험 (나)에서 남은 기체는 기체 B이다.
ㄷ. 기체 A와 기체 B는 2 : 1의 부피비로 반응한다.
ㄴ. 실험 (나)에서 남은 기체는 기체 B이다.
ㄷ. 기체 A와 기체 B는 2 : 1의 부피비로 반응한다.
① ㄱ
② ㄴ
③ ㄷ
④ ㄱ, ㄴ
⑤ ㄱ, ㄷ
67. 그림은 어떤 원소()의 산화물 (가), (나), (다)에서 일정량의 와 결합하는 산소의 질량비를 막대 그래프로 나타낸 것이다.
(가)의 화학식이 라 하면 (나)와 (다)의 화학식은?
① (나) : / (다) :
② (나) : / (다) :
③ (나) : / (다) :
④ (나) : / (다) :
⑤ (나) : / (다) :
68. 영희는 다음 자료를 이용하여 마그네슘()의 원자량을 구하려고 한다.
◦ 염산과 마그네슘과의 화학 반응식은 다음과 같다.
◦ 마그네슘 0.1g과 충분한 양의 묽은 염산을 반응시켰더니 수소기체 100mL가 발생하였다.
◦ 마그네슘 0.1g과 충분한 양의 묽은 염산을 반응시켰더니 수소기체 100mL가 발생하였다.
위 자료로부터 마그네슘의 원자량을 구하려면 추가로 필요한 자료는?
① 아보가드로수
② 수소의 분자량
③ 염화수소의 분자량
④ 반응한 염산의 농도
⑤ 실험 조건에서 기체 1몰의 부피
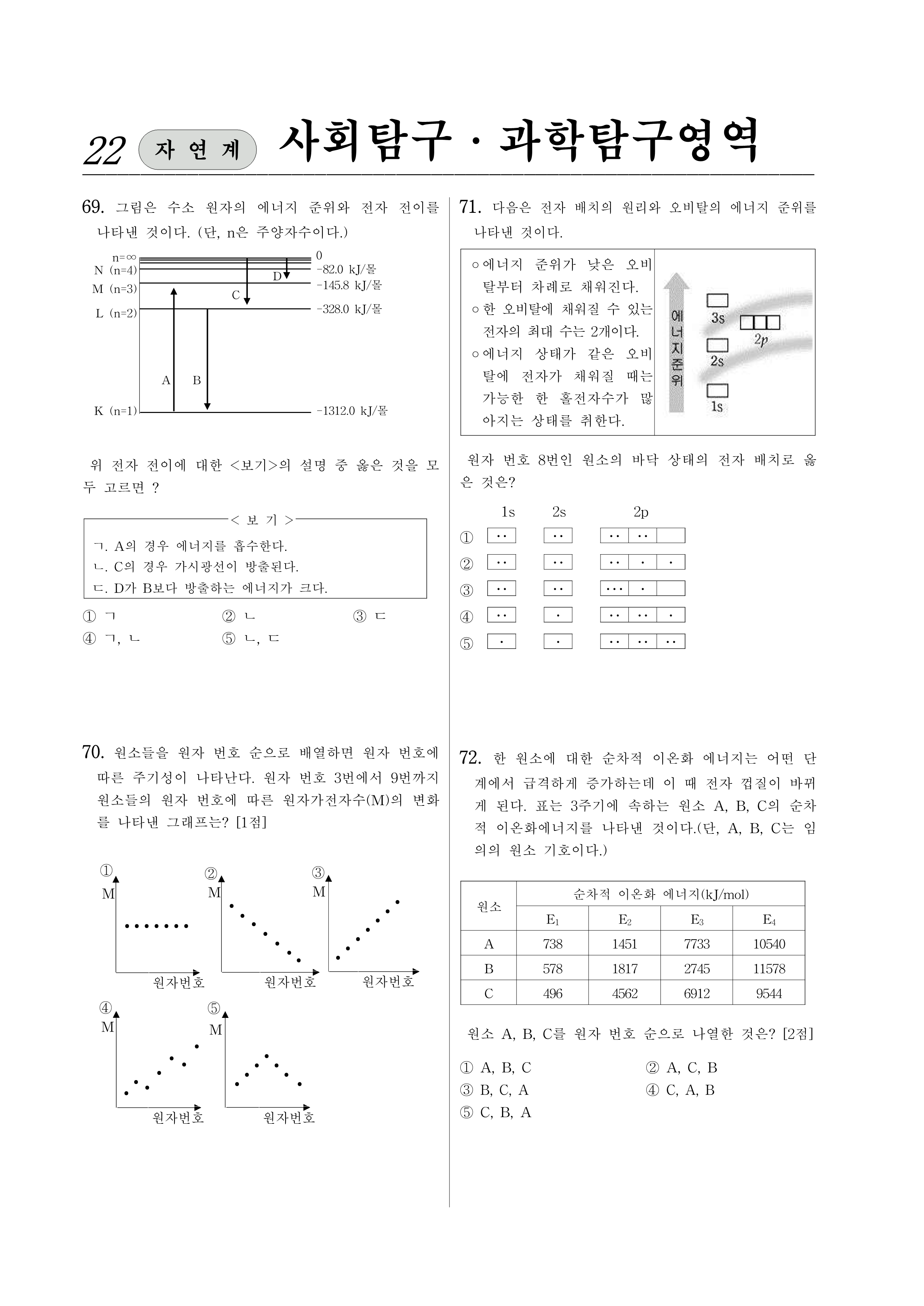
69. 그림은 수소 원자의 에너지 준위와 전자 전이를 나타낸 것이다. (단, n은 주양자수이다.)
위 전자 전이에 대한 <보기>의 설명 중 옳은 것을 모두 고르면?
<보 기>
ㄱ. A의 경우 에너지를 흡수한다.
ㄴ. C의 경우 가시광선이 방출된다.
ㄷ. D가 B보다 방출하는 에너지가 크다.
ㄴ. C의 경우 가시광선이 방출된다.
ㄷ. D가 B보다 방출하는 에너지가 크다.
① ㄱ
② ㄴ
③ ㄷ
④ ㄱ, ㄴ
⑤ ㄴ, ㄷ
70. 원소들을 원자 번호 순으로 배열하면 원자 번호에 따른 주기성이 나타난다. 원자 번호 3번에서 9번까지 원소들의 원자 번호에 따른 원자가전자수(M)의 변화를 나타낸 그래프는? [1점]
71. 다음은 전자 배치의 원리와 오비탈의 에너지 준위를 나타낸 것이다.
◦ 에너지 준위가 낮은 오비탈부터 차례로 채워진다.
◦ 한 오비탈에 채워질 수 있는 전자의 최대 수는 2개이다.
◦ 에너지 상태가 같은 오비탈에 전자가 채워질 때는 가능한 한 홀전자수가 많아지는 상태를 취한다.
◦ 한 오비탈에 채워질 수 있는 전자의 최대 수는 2개이다.
◦ 에너지 상태가 같은 오비탈에 전자가 채워질 때는 가능한 한 홀전자수가 많아지는 상태를 취한다.
원자 번호 8번인 원소의 바닥 상태의 전자 배치로 옳은 것은?
72. 한 원소에 대한 순차적 이온화 에너지는 어떤 단계에서 급격하게 증가하는데 이 때 전자 껍질이 바뀌게 된다. 표는 3주기에 속하는 원소 , , 의 순차적 이온화에너지를 나타낸 것이다. (단, , , 는 임의의 원소 기호이다.)
| 원소 | 순차적 이온화 에너지(kJ/mol) | |||
| A | 738 | 1451 | 7733 | 10540 |
| B | 578 | 1817 | 2745 | 11578 |
| C | 496 | 4562 | 6912 | 9544 |
원소 , , 를 원자 번호 순으로 나열한 것은? [2점]
① , ,
② , ,
③ , ,
④ , ,
⑤ , ,
73. 다음은 두 착화합물의 배위수와 중심 금속 이온을 나타낸 것이다.
| 착화합물 | ||
| 배위수 | 4 | 6 |
| 중심 금속 이온 |
위 착화합물이 각각 같은 몰수 녹아 있는 두 수용액에 충분한 양의 질산은 수용액을 각각 가했을 때 생성되는 앙금()의 몰수비는?
①
②
③
④
⑤
74. 다음은 물()과 암모니아()가 수소이온()과 결합하여 옥소늄이온()과 암모늄이온()이 만들어지는 것을 화학 반응식으로 나타낸 것이다.
분자나 이온인 (가)~(라)에 대한 설명으로 옳지 않은 것은?
① (가)는 (나)보다 결합각이 작다.
② (가)는 평면 구조이고 (나)는 입체 구조이다.
③ (나)와 (라)에는 배위 결합이 존재한다.
④ (다)는 무극성 분자이다.
⑤ (라)는 정사면체 구조이다.
75. 물은 <보기>와 같은 독특한 성질을 갖고 있다.
<보 기>
◦ 비열이 크다.
◦ 기화열이 크다.
◦ 표면장력이 크다.
◦ 고체로 될 때 밀도가 감소한다.
◦ 기화열이 크다.
◦ 표면장력이 크다.
◦ 고체로 될 때 밀도가 감소한다.
다음 중 <보기>와 같은 물의 특성으로 인해 일어나는 현상과 관련이 없는 것은?
① 순수한 물은 전기를 통하지 않는다.
② 여름철에 땀을 흘려 체온을 유지한다.
③ 나뭇잎에 물방울이 동그랗게 맺혀있다.
④ 강이나 호수가 얼면 표면에서부터 얼기 시작한다.
⑤ 해안지방의 일교차가 내륙지방의 일교차보다 작다.
76. 다음의 주기율표에서 (가)~(마)의 원소들끼리 이온 결합을 형성하였을 때, 녹는점이 가장 높은 화합물을 만드는 원소의 짝은?
① (가)와 (다)
② (가)와 (마)
③ (나)와 (다)
④ (나)와 (라)
⑤ (나)와 (마)
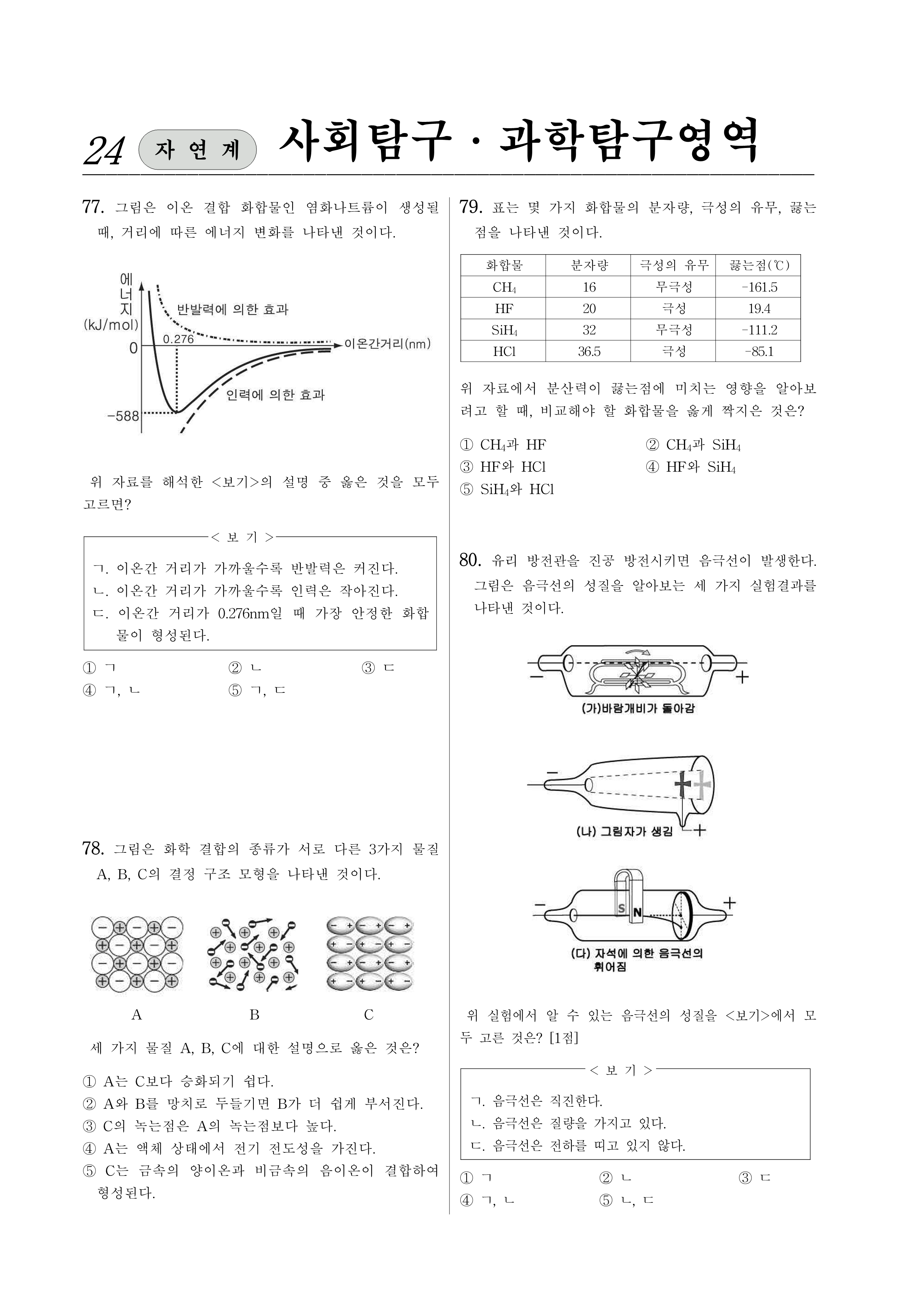
77. 그림은 이온 결합 화합물인 염화나트륨이 생성될 때, 거리에 따른 에너지 변화를 나타낸 것이다.
위 자료를 해석한 <보기>의 설명 중 옳은 것을 모두 고르면?
<보 기>
ㄱ. 이온간 거리가 가까울수록 반발력은 커진다.
ㄴ. 이온간 거리가 가까울수록 인력은 작아진다.
ㄷ. 이온간 거리가 0.276nm일 때 가장 안정한 화합물이 형성된다.
ㄴ. 이온간 거리가 가까울수록 인력은 작아진다.
ㄷ. 이온간 거리가 0.276nm일 때 가장 안정한 화합물이 형성된다.
① ㄱ
② ㄴ
③ ㄷ
④ ㄱ, ㄴ
⑤ ㄱ, ㄷ
78. 그림은 화학 결합의 종류가 서로 다른 3가지 물질 A, B, C의 결정 구조 모형을 나타낸 것이다.
세 가지 물질 A, B, C에 대한 설명으로 옳은 것은?
① A는 C보다 승화되기 쉽다.
② A와 B를 망치로 두들기면 B가 더 쉽게 부서진다.
③ C의 녹는점은 A의 녹는점보다 높다.
④ A는 액체 상태에서 전기 전도성을 가진다.
⑤ C는 금속의 양이온과 비금속의 음이온이 결합하여 형성된다.
79. 표는 몇 가지 화합물의 분자량, 극성의 유무, 끓는점을 나타낸 것이다.
| 화합물 | 분자량 | 극성의 유무 | 끓는점(℃) |
| 16 | 무극성 | -161.5 | |
| 20 | 극성 | 19.4 | |
| 32 | 무극성 | -111.2 | |
| 36.5 | 극성 | -85.1 |
위 자료에서 분산력이 끓는점에 미치는 영향을 알아보려고 할 때, 비교해야 할 화합물을 옳게 짝지은 것은?
① 과
② 과
③ 와
④ 와
⑤ 와
80. 유리 방전관을 진공 방전시키면 음극선이 발생한다. 그림은 음극선의 성질을 알아보는 세 가지 실험결과를 나타낸 것이다.
위 실험에서 알 수 있는 음극선의 성질을 <보기>에서 모두 고른 것은? [1점]
<보 기>
ㄱ. 음극선은 직진한다.
ㄴ. 음극선은 질량을 가지고 있다.
ㄷ. 음극선은 전하를 띠고 있지 않다.
ㄴ. 음극선은 질량을 가지고 있다.
ㄷ. 음극선은 전하를 띠고 있지 않다.
① ㄱ
② ㄴ
③ ㄷ
④ ㄱ, ㄴ
⑤ ㄴ, ㄷ
'고3 > 과학' 카테고리의 다른 글
| 2002-03 고3 학평 과학(자연계선택/지구과학Ⅱ) (0) | 2023.02.08 |
|---|---|
| 2002-03 고3 학평 과학(자연계선택/생물Ⅱ) (0) | 2023.02.08 |
| 2002-03 고3 학평 과학(자연계선택/물리Ⅱ) (0) | 2023.02.08 |
| 2002-03 고3 학평 과학(자연계공통) (0) | 2023.02.08 |
| 2002-03 고3 학평 과학(인문계) (0) | 2023.02.08 |